近日,药学院叶文才/张冬梅团队连续在国际权威学术期刊Nature Metabolism和Advanced Science在线发表题为“ENO2-derived phosphoenolpyruvate functions as an endogenous inhibitor of HDAC1 and confers resistance to antiangiogenic therapy”和“TCAF2 in pericytes promotes colorectal cancer liver metastasis via inhibiting cold-sensing TRPM8 channel”的研究论文,分别报道了代谢重编程介导肿瘤对血管靶向药物耐药的新颖机制,以及周细胞离子通道调控肿瘤血行转移的分子机制。

摘自Nat Metab, 2023:10.1038/s42255-023-00883-y

摘自Adv Sci. 2023:e2302717.
结直肠癌(colorectal cancer, CRC)肝转移是肿瘤致死的主要原因,血管靶向药物广泛应用于转移性CRC的临床治疗,但耐药频发,亟需探究其机制和解决方案。该团队从代谢重编程的角度研究了血管靶向药物耐药的调控新机制,发现糖酵解酶烯醇化酶ENO2是驱动CRC对血管靶向药物耐药的关键因素,ENO2代谢产物磷酸烯醇丙酮酸(PEP)能选择性与HDAC1结合并抑制其活性,从而提高β-catenin乙酰化并激活β-catenin通路,进而促进CRC细胞恶性行为和耐药。联合使用ENO2抑制剂能有效克服血管靶向药物耐药。该研究表明ENO2有望作为CRC对血管靶向药物耐药的预测性生物标志物和潜在治疗靶点,并首次揭示代谢产物PEP作为HDAC1抑制剂的新功能及其在血管靶向药物耐药中发挥的重要作用(Nat Metab, 2023:10.1038/s42255-023-00883-y)。
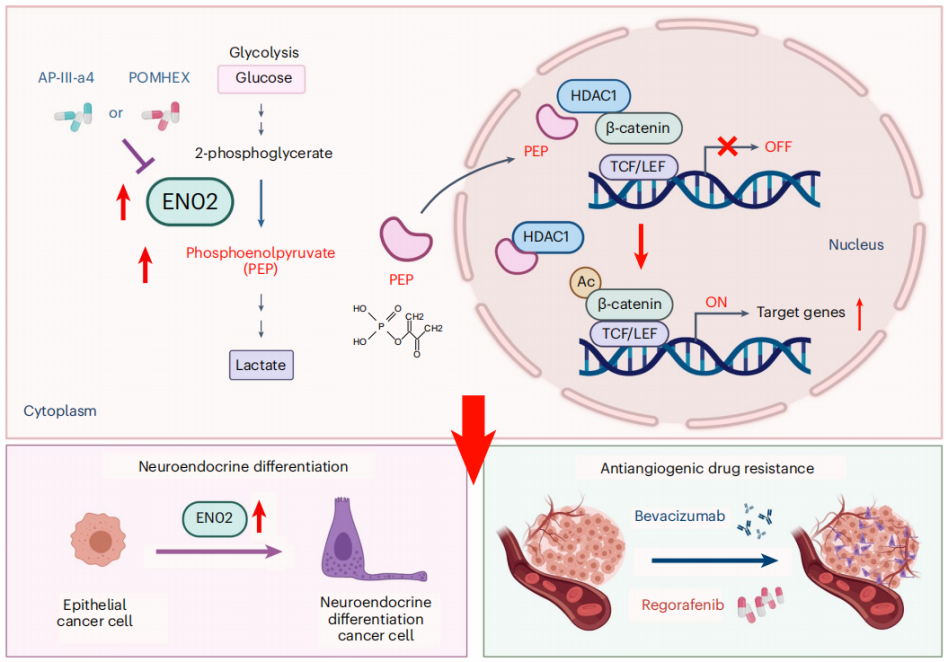
肿瘤细胞ENO2代谢重编程促进血管靶向药物耐药的作用机制图
血行转移是CRC肝转移的最主要途径,而原发灶肿瘤细胞渗入肿瘤血管是血行转移的关键限速步骤。作为肿瘤血管的“守门员”,周细胞监管着肿瘤细胞渗入血管的过程,但调控机制仍不明确。该团队使用显微分离结合周细胞培养基条件培养的方法,从CRC患者手术切除的肿瘤组织中分离获得了周细胞,并通过蛋白质组学研究发现,CRC肝转移病人来源的肿瘤周细胞高表达TRP 通道相关因子2(TRP channel-associated factor 2,TCAF2)。TCAF2通过抑制TRPM8冷感受离子通道TRPM8的表达和活性,诱导肿瘤周细胞分泌Wnt 5a,激活STAT3信号通路促进肿瘤细胞EMT和血行转移。TRPM8通道激动剂薄荷醇能有效抑制CRC肝转移。该研究首次揭示了血行转移过程中周细胞冷感受蛋白及其调控因子的新功能,为CRC肝转移治疗提供潜在新靶点(Adv Sci. 2023:e2302717)。
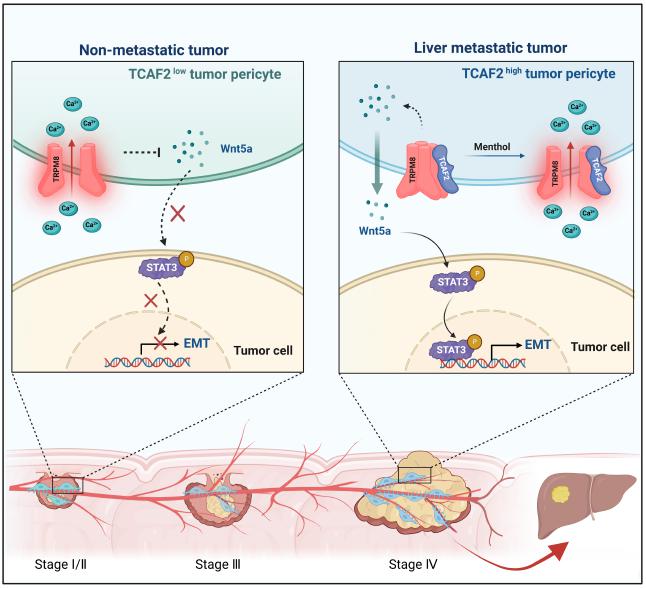
周细胞TCAF2促进结直肠癌肝转移的作用机制图
近年来,叶文才/张冬梅团队深入研究肿瘤耐药和转移的调控新机制,还发现TCF21、ASCT2等潜在抗肿瘤药物新靶标(Gut, 2023; J Clin Invest,2022; Drug Resist Updat, 2023a、2022b; J Extracell Vesicles,2021),获得系列天然来源的抗肿瘤耐药和转移的新药先导物(J Clin Invest, 2017; Mol Cancer, 2022; Signal Transduct Target Ther, 2020; J Immunother Cancer, 2023),获授权国际发明专利8项,中国发明专利6项,1个候选新药品种正在开展临床前研究。
上述系列研究工作得到了国家自然科学基金、广东省“珠江人才计划”本土创新科研团队、广东省重点领域研发计划等项目的大力支持。
论文链接:https://www.nature.com/articles/s42255-023-00883-y
https://onlinelibrary.wiley.com/doi/10.1002/advs.202302717
![{{siteInfoList.info[5].siteInfo}}](/_upload/tpl/05/36/1334/template1334/images/top_logo.png)

